感谢您选择深圳市疾病预防控制中心医疗器械临床试验机构合作,我中心于2023年11月24日完成国家药品监督管理局医疗器械临床试验机构备案,备案号为20230169,备案专业为病原微生物学。
为保证临床试验高质量完成,机构参照GCP相关法律法规制定了完整的管理制度和标准操作规程,使机构各项工作有法可依,从而保证机构临床试验工作合规化,有力保障临床试验过程规范,结果真实、可靠、准确、可追溯。
一、试验项目的承接范围
体外诊断试剂临床试验项目
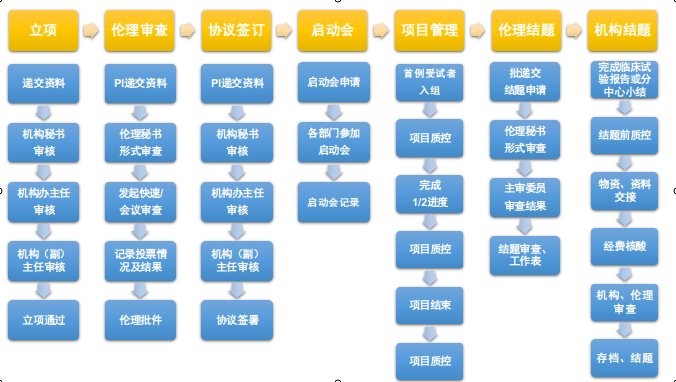
二、深圳市疾病预防控制中心项目运行流程图
三、立项资料递交
1.请按我中心《体外诊断试剂临床试验递交资料目录》中的顺序准备纸质版立项申请资料。
2.《体外诊断试剂临床试验递交资料目录》中的《体外诊断试剂临床试验立项申请表》、《医疗器械临床试验委托函》、《主要研究者责任声明》、《申办者/CRO资料真实性声明》需自行下载我机构《临床试验立项标准操作规程》中附表。递交立项资料文件夹前须发送电子版至机构办邮箱 。
。
3.需以我中心《体外诊断试剂临床试验递交资料目录》作为目录使用,表格的“报送资料目录”一栏中标明各项资料的版本号和版本日期。
4.申办方提供的资料均需盖章后递交(首页+骑缝)。用A4黑色快劳夹装订,用11孔活页文件装订好,并附分页纸。
5.文件夹需打印大小适宜的侧标,侧标内容及格式见《临床试验立项标准操作规程》附件。
四、工作指引
附件1 临床试验项目运作标准操作规程
附件2 临床试验立项标准操作规程
五、机构办公室联系方式
办公电话:0755-25604305
邮箱:
地址:518055,深圳市南山区龙苑路8号深圳市疾病预防控制中心5号楼







